细胞自噬是真核生物在应对各种逆境及衰老过程中,通过自我降解为细胞提供营养物质的重要生命活动过程,是生命科学的前沿热点研究领域。细胞自噬由众多的自噬蛋白ATG驱动,其起始和形成有着非常复杂的调控机制,在各类生物中的机制也不尽相同。已经发现植物中细胞自噬的发生受ATG1-ATG13激酶复合物的精密调控:在营养充足的条件下,ATG13蛋白由于被蛋白激酶快速磷酸化,抑制细胞自噬的发生;当受到营养缺乏等胁迫时,ATG13蛋白被去磷酸化,诱导细胞自噬以便植物应对不良环境。但参与调控该重要过程的植物蛋白磷酸酶多年来一直是一个谜。
近日,植物学国际权威期刊The Plant Cell 发表了bat365在线平台官网地址研究人员的最新成果:“Type One Protein Phosphatase Regulates Fixed-Carbon Starvation-Induced Autophagy in Arabidopsis”(https://doi.org/10.1093/plcell/koac251),发现植物I型蛋白磷酸酶TOPP(Type One Protein Phosphatase)家族可以通过细胞自噬关键蛋白ATG13a的去磷酸化修饰,调控ATG1-ATG13激酶复合体的磷酸化状态,启动了植物细胞自噬的发生。该重要发现为深入理解植物细胞自噬发生的分子机理提供了重要证据和思路。
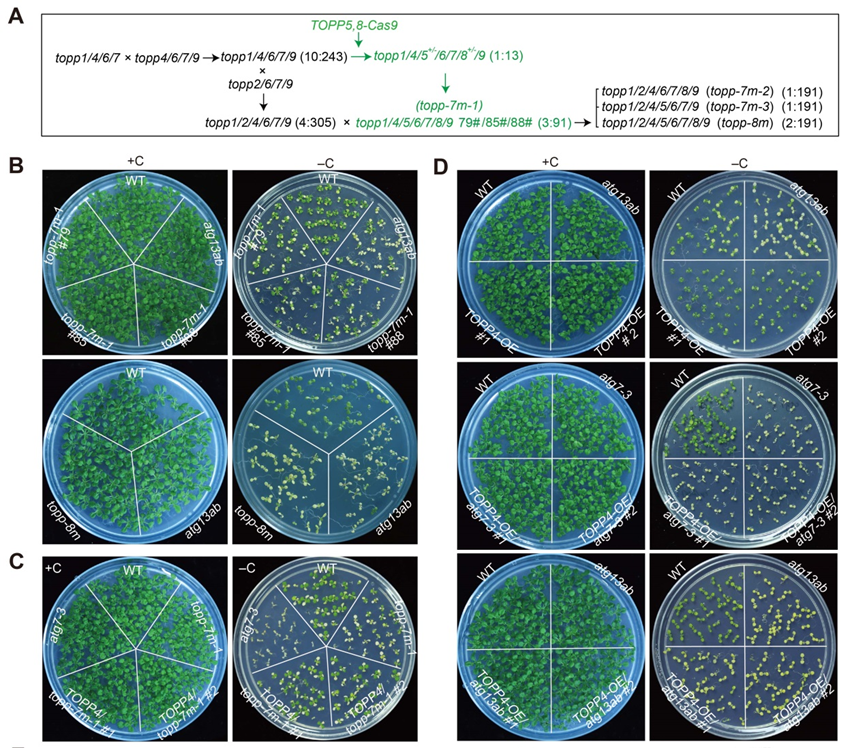
图1.缺乏至少7个TOPP成员的植株对碳饥饿非常敏感。
由于I型蛋白磷酸酶家族在模式植物拟南芥中由高度冗余的9个基因组成,所以单个基因缺失后较难观察到明显的缺陷表型。研究人员经过多年努力,通过基因编辑等技术遗传杂交构建了高阶突变体,发现TOPP七重突变体(topp-7m)和八重突变体(topp-8m)在缺碳处理后幼苗出现早衰,与发现的自噬突变体的表型极为相似(图1),并且它们的自噬活性都受到了显著抑制。
为了解析TOPP调控细胞自噬的分子机制,研究人员通过质谱技术高通量筛选TOPP的互作蛋白,鉴定到一个启始细胞自噬的关键组分ATG13a,并通过酵母双杂交、免疫共沉淀等技术验证了TOPPs与ATG13a之间的相互作用;进一步实验证明TOPP确实在体内能将ATG13a直接去磷酸化(图2)。深入对ATG13a蛋白进行研究,鉴定到其18 个关键的磷酸化位点;将这些位点的丝氨酸或苏氨酸全部突变为丙氨酸,模拟去磷酸化状态(ATG13a18A),显著提高了细胞自噬,增强了植物对缺碳的耐受性;而将其全部突变为天冬氨酸模拟ATG13a磷酸化状态(ATG13a18D),只部分恢复了自噬突变体atg13ab的缺碳敏感表型以及自噬活性(图3)。研究还发现,模拟去磷酸化状态的ATG13a18A与ATG1a 的相互作用显著增强;而模拟磷酸化状态的ATG13a18D与 ATG1a 的结合减弱;相应地,在去磷酸化缺陷的topp-7m突变体中 ATG13a与ATG1a的相互作用能力确实减弱了很多,说明 TOPP通过影响 ATG13a的磷酸化状态调控了激酶复合体ATG1a-ATG13a的形成(图3)。
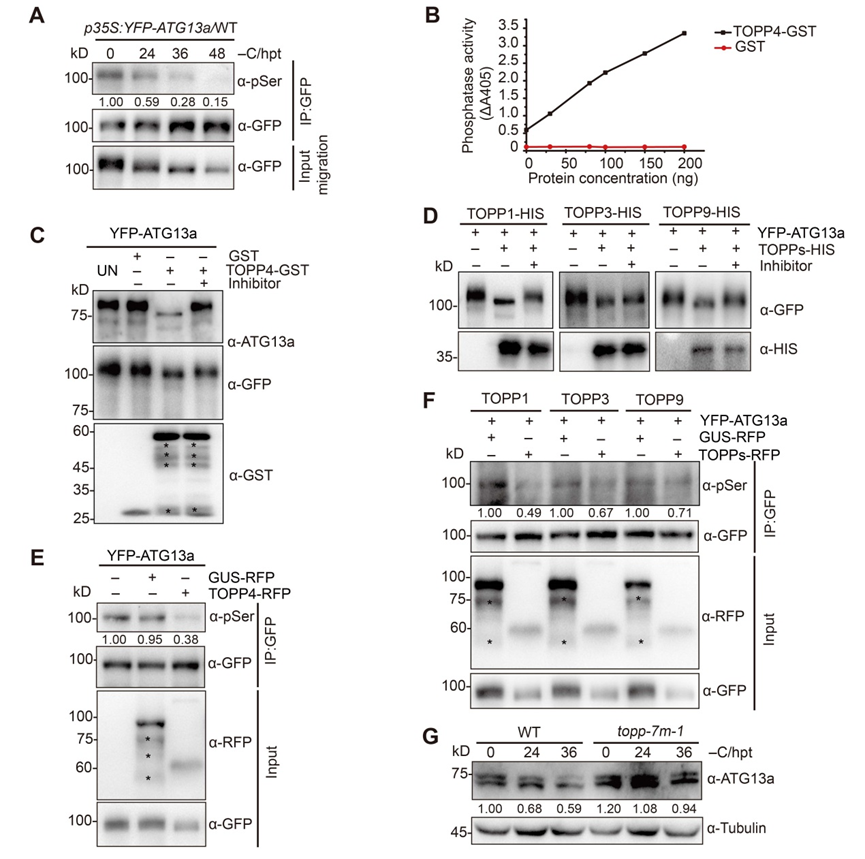
图2. TOPP能将ATG13a去磷酸化
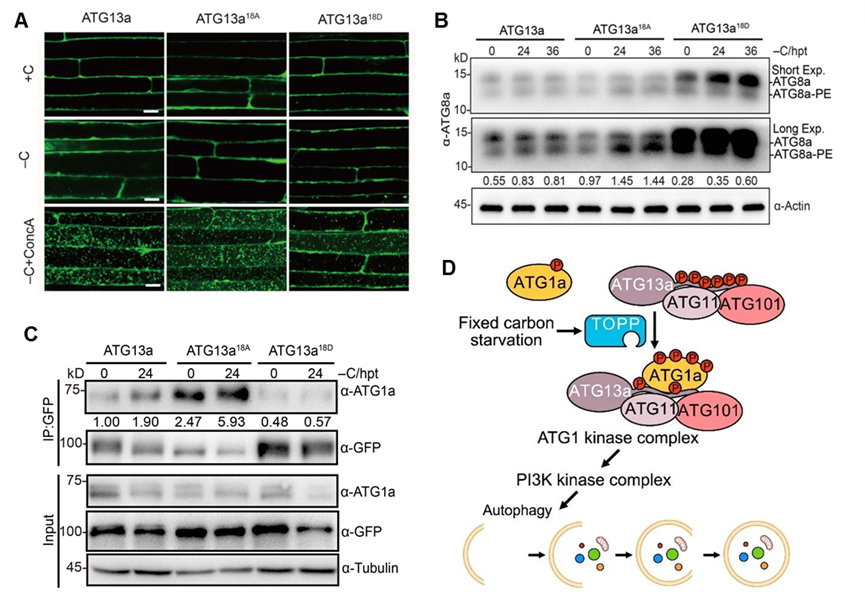
图3. ATG13a去磷酸化增强了碳饥饿诱导的细胞自噬,且与ATG1a的相互作用更强
该研究首次发现植物 I型蛋白磷酸酶TOPP 通过对ATG13蛋白去磷酸化促进缺碳诱导的细胞自噬,延缓植物的早衰,为研究植物细胞自噬发生的调控机制提供了新思路;同时,由于细胞自噬与植物的抗逆性反应密切相关,所以本发现也有望应用于农业生产提高作物抗逆性能。
I型蛋白磷酸酶,也称蛋白磷酸酶1(Protein Phosphatase 1,PP1),是真核生物中重要的丝氨酸/苏氨酸蛋白磷酸酶之一,调控了细胞许多重要的生命活动。侯岁稳教授团队长期致力植物PP1遗传功能解析工作,2014年在国际上首次报道了植物PP1调控赤霉素信号通路的机理。随后发现TOPP家族不仅参与了其它重要植物激素信号响应,如生长素和脱落酸等,而且在植物响应各种环境(如光和病原物侵害等)中发挥着重要的调控功能,系列成果多次发表在植物学国际主流期刊PLoS Genetics、Plant Physiology、Plant Journal等,引领了该领域的发展。目前,该团队正在进行植物TOPP参与盐、低温响应的研究工作,还在开展重要农作物中TOPP的基因编辑工作,以期培育抗逆、抗病农作物新品种。
本研究中侯岁稳课题组博士后王秋玲和青年教师秦倩倩为论文的共同第一作者,侯岁稳教授为通讯作者。该研究得到了国家自然科学基金、bat365在线平台官网地址长江学者奖励计划等经费的资助。
论文链接:https://doi.org/10.1093/plcell/koac251


