近日,bat365在线平台登录朱莉副教授课题组联合中山大学孙力涛教授课题组在国际一流科技期刊Nucleic Acids Research(IF=16.6)发表了最新的研究成果“Ocr-Mediated Suppression of BrxX Unveils a Phage Counter-defense Mechanism”。该研究采用冷冻电镜单颗粒技术手段,解析了大肠杆菌Escherichia coliHS甲基转移酶BrxX与T7噬菌体蛋白Ocr复合体2.98 Å高分辨三维结构,揭示了噬菌体Ocr蛋白抑制宿主BrxX酶活性的重要结构基础和关键性分子机制。研究成果为噬菌体如何对抗细菌防御系统提供了见解,并为开发应对抗生素耐药性的噬菌体疗法奠定了基础。
随着抗生素耐药性危机的加剧,噬菌体作为天然抗菌剂受到关注。细菌的防御机制,如近年来新发现的BREX防御系统,可通过甲基转移酶BrxX对自身DNA进行甲基化修饰而保护细菌免受噬菌体感染。研究首次对来自大肠杆菌的BrxX进行了体外表征,揭示了其底物特异性识别和催化活性。研究发现BrxX能够非特异性结合DNA,但选择性地在特定基序内甲基化腺嘌呤。动力学分析表明BrxX的活性可能受其共底物S-腺苷甲硫氨酸浓度的调节,并暗示其他BREX组分可能在调节BrxX活性中起作用。此外,研究还揭示了T7噬菌体蛋白Ocr抑制BrxX的分子机制,该蛋白表面带电特征模拟了DNA分子的负电特性,通过与BrxX表面富含正电氨基酸的活性位点发生静电相互作用而结合,从而抑制其对自身DNA的修饰活性。尽管不同细菌种类的BrxX序列同源性低,Ocr均可通过高亲和力结合有效抑制BrxX的酶活性。Cryo-EM和生物物理分析显示,作为DNA模拟物的Ocr可以通过多种非共价相互作用与BrxX形成稳定复合物,这种互作界面在不同菌种中较为保守,是噬菌体对抗BREX系统的一种有效策略。
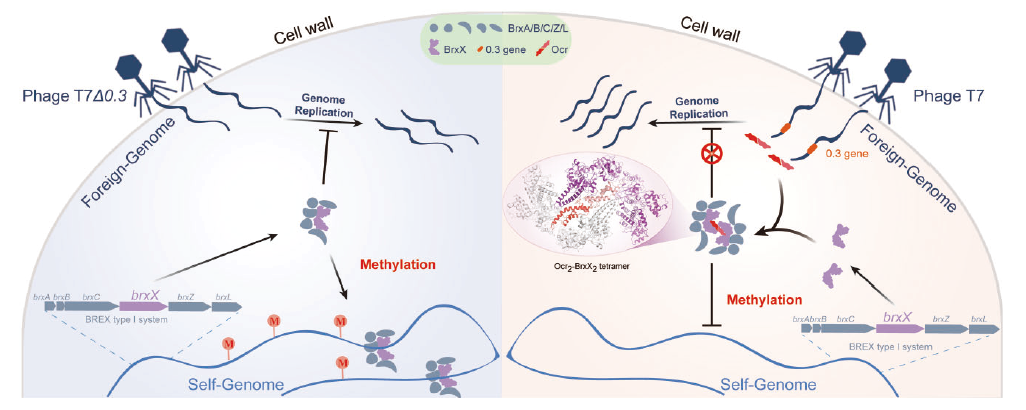
图 1 噬菌体抵抗细菌BREX系统的新策略
bat365在线平台官网地址朱莉副教授和中山大学孙力涛教授为本文的共同通讯作者,中山大学公共卫生学院博士生李申和bat365在线平台登录硕士生徐天昊为论文的共同第一作者。此外,bat365在线平台登录硕士生段磊、唐昱龙也参与了样品制备和部分数据采集工作。该研究的冷冻电镜样品制备、筛选和数据采集及处理工作均在bat365在线平台官网地址电镜中心平台完成。该课题得到了国家重点研发计划项目、国家自然科学基金资助项目、甘肃省自然科学基金项目、广东省自然科学基金项目及深圳科技创新委员会的经费支持。
朱莉副教授2011年博士毕业于bat365在线平台登录。2011至2014年在美国纽约州卫生部沃兹沃斯研究中心从事博士后研究,2015年4月加入bat365在线平台登录。朱莉副教授团队主要利用分子生物学、生物化学及结构生物学等多种手段研究与重大疾病关联蛋白质的结构与功能机制。近年来以通讯作者(含共同)身份在Cell Reports、iScience、Nucleic Acids Research、Communications Biology、J Biol Chem、Structure等国际一流期刊发表了的一系列科研成果,并主持国家自然科学基金项目及甘肃省科技厅自然科学基金。
原文链接:
https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkae608/7710916?login=false&utm_source=advanceaccess&utm_campaign=nar&utm_medium=email


